癌细胞转移的体外研究取得突破
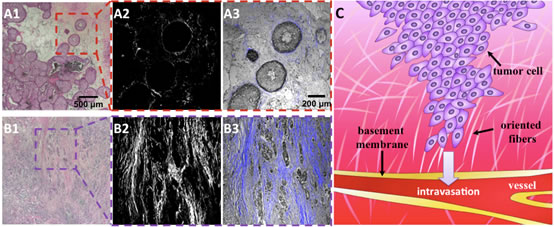
癌症的巨大威胁在于其危及生命,而其致命的主要原因之一就是肿瘤细胞发生临床上转移,且不可逆转。肿瘤细胞侵袭和转移过程的研究对于深入理解癌症的致命机理,探索更为有效的治疗手段至关重要。但是肿瘤细胞的侵袭环境和转移过程尤为复杂,而其中三维微环境对侵袭转移有着关键性的影响作用。如图1所示,在发生转移的乳腺癌晚期组织中可以观察到明显不同是早期组织中的细胞间质环境:大量有取向性的胶原蛋白纤维的出现,与肿瘤细胞侵袭方向高度一致。针对这些纤维的存在,科学家有一个猜测:其取向性对肿瘤细胞的侵袭有着导向作用,因而能促进肿瘤细胞的侵袭。同时,这些纤维的形成与取向与肿瘤细胞的迁移与侵袭有没有什么关联,也有待诠释。倘若能够在活体外构建出更逼真的肿瘤细胞侵袭的三维微环境,特别是在其中实现有取向的,对于研究细胞侵袭模型,理解癌症转移性的机理及调控微环境来阻止或减弱基转移性都具有十分重要的意义。

| 图1. 不同阶段乳腺癌组织切片成像。(A1、A3)是癌症初期H&E-染色的组织切片成像,而(A2)是二次谐波成像展示胶原蛋白的分布-其纤维包裹在细胞周围。(B1-B3)是癌症晚期相应成像,显示肿瘤细胞与取向的胶原蛋白纤维相互作用来侵袭迁移。(C)转移性乳癌细胞侵袭组织向血管转移过程的示意图。 |
在过去一年,重庆大学物理学院的刘雳宇教授与普林斯顿大学Robert Austin教授,亚利桑那州立大学的焦阳教授,沙特国王大学张西祥教授,及中国科学院物理研究所/北京凝聚态物理国家实验室(筹)软物质物理重点实验室合作,利用微加工工艺结合胶原蛋白和琼胶基质微流分层技术在体外构建出一种模拟肿瘤细胞侵袭的三维微环境(如图2所示)。这种胶原蛋白-琼胶-胶原蛋白三明治结构在恒温37度一定时间后,胶原蛋白会形成纤维。而且胶原蛋白纤维在胶原蛋白与琼胶界面处有较高的取向性-垂直于界面。而此三明治结构中的力场分析揭示此结构巧妙的利用了胶原蛋白层与琼胶层材料间的应力,使得其界面处胶原蛋白纤维取向较一致。这也为人工控制胶原蛋白纤维在三维微环境中的取向性提供了实验思路。利用荧光共聚焦成像,刘雳宇组研究对比了转移性肿瘤细胞MDA-MB-231和非转移性肿瘤细胞MCF-7,在此三维体外微环境中的侵袭特性,并得到了如下的重要发现:1)转移性肿瘤细胞在转移侵袭过程中取向与胶原蛋白纤维高度一致;2)在胶原蛋白与琼胶之间的界面上,肿瘤细胞沿胶原蛋白纤维侵入到了琼胶之中,这些结果都显示了胶原蛋白纤维对癌细胞的侵袭有协助作用。3)随着时间的推移,癌细胞能更加深入到较硬的琼胶层中,胶原蛋白纤维与之相伴(如图3),暗示细胞可能也能帮助胶原蛋白纤维的生成并利用它反过来协助其侵袭;4) 胶原蛋白纤维协助肿瘤细胞侵袭的影响可能在较长的距离仍然存在,使得肿瘤细胞甚至突破琼胶到达旁边的培养基通道(如图3)。
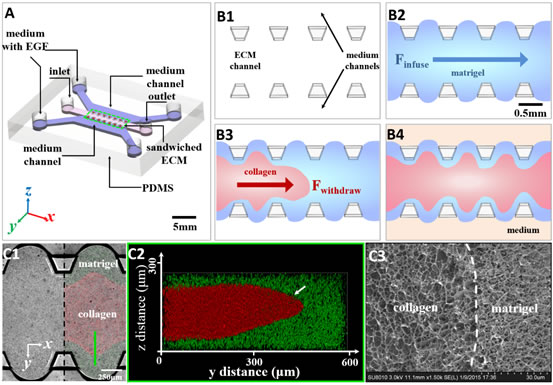
| 图2. 三明治型细胞外间质在微流体芯片中的形成及表征。(A) PDMS微流体芯片示意图,3-D三明治型ECM在中间通道,而培养基 (有EGF) 在两边的通道。(B1-B4)三明治型ECM形成过程。首先,注入琼胶液(蓝色)到ECM通道中(B2);接着利用出口处负压在琼胶中部注入胶原蛋白液(红色) (B3);注入后,三明治ECM在37度固化30分钟,然后两边的通道再加入培养液(B4)。共聚焦显微镜显示三明治结构平面成像(C1)和z方向成像(C2)。冷冻电镜图(C3)展示胶原蛋白和琼胶界面,其初始界面是很清晰的。 |
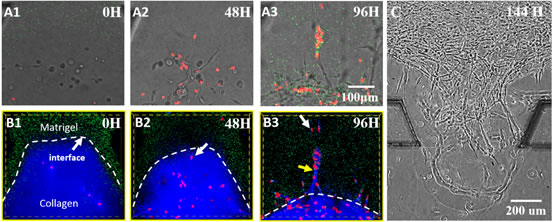
| 图3. 在复合ECM中增强的MDA-MB-231细胞的侵袭过程。(A1-A3) 每隔48小时侵袭细胞的明场成像快照;(B1-B3) 相应荧光成像,琼胶区域埋入绿色荧光微球,胶原蛋白区域蓝色,而细胞核染成红色。很明显96小时时,胶原蛋白纤维引导的细胞聚集并强烈地侵袭到了硬的琼胶之中,呈单股状。(C) 在144小时时,细胞突破琼胶,到达边上的培养液通道,展示了胶原蛋白纤维增强的MDA-MB231细胞侵袭的长距离影响。 |
一直以来,癌症都是医学上的重大疑难问题,刘雳宇团队的实验结果则为其控制和治疗提出了新思路,有着很好的指导意义。已有报道指出癌症病人的放化疗过程中常引起胶原蛋白纤维的取向。这就为治疗后残存癌细胞提供了侵袭的“高速公路”,从而导致后序癌细胞转移的恶化结果。如果治疗时,也考虑对这些癌细胞微环境的改造,或者直接对癌症病人采用相应微环境的控制治疗,提前抑制胶原蛋白结构的取向性,就能破坏癌细胞快速侵袭的“高速公路”,进而延长甚至拯救癌症病人的生命。
相关结果发表在PNAS杂志(Proc. Natl. Acad. Sci. USA (2016))上。该工作得到了国家973计划、国家自然科学基金和重庆大学引进人才启动基金的资助。